Prix Nobel de chimie : Jean-Marie LEHN (1987)
Prix Nobel de chimie de Jean-Marie Lehn (1987)
-
Biographie :
Jean-Marie Lehn est né le 30 septembre 1939 à Rosheim (Alsace). Ce chimiste français a tout d’abord travaillé comme chercheur du CNRS, puis est devenu professeur sans chaire (cf lexique) à l’université de Strasbourg. Depuis 1972, il est professeur invité dans différentes universités et depuis 1979, professeur dans le collège de France. Il a effectué ses principaux travaux sur la chimie supramoléculaire qui lui ont valu son prix Nobel de Chimie en 1987.

-
La découverte :
Travaillant en collaboration avec les chercheurs Charles J. PEDERSEN et Donald J. CRAM , Jean-Marie Lehn va étudier la chimie supramoléculaire et ainsi devenir un « architecte » des molécules. En effet, on lui doit la possibilité d’élaborer des molécules jusqu’à maintenant inconnues. Lehn se lance en 1969 dans des recherches sur la synthèse de molécules tridimentionnelles permettant plus que les couronnes plates (voir éther-couronne ci-dessous), la sélectivité des « captures » d’ions. Ses travaux sont d’autant plus intéressants qu’ils font le lien entre la chimie moléculaire et la chimie du vivant puisque l’on retrouve les mêmes phénomènes de reconnaissance et de réception que dans une réaction enzymatique par exemple. Lehn parle ainsi de « récepteur » et de « substrat ».
-
Les travaux de la chimie supramoléculaire et les cryptands :
La chimie supramoléculaire est une catégorie de la chimie dont le principal but est l’étude de l’assemblage moléculaire. Jean-Marie Lehn a travaillé sur ce projet et plus particulièrement sur les cryptands, également appelés molécules creuses, et les éthers-couronnes.
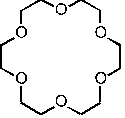
Les éthers-couronnes sont des polyéthers cycliques, de la forme (CH2-CH2-O)n (voir le schéma ci-dessous) :
Un éther couronne (18-couronne-6)
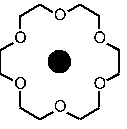
Un cation métallique complexé
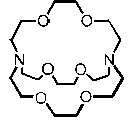
Les cryptands sont des molécules analogues mais en 3D (voir les schéma ci-dessous) :
Un cryptand
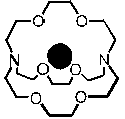
Un cryptate
Ces molécules sont capables de «complexer» ou d’emprisonner un cation, soit retenir un ion ou une molécule très fortement. Les oxygènes, qui sont électronégatifs, ont la force de retenir, tous ensembles (et grâce à cette formation croisée, intéractions), un cation qui leur correspond. En effet, pour qu’un complexe stable se forme, il faut que le cation s’adapte parfaitement à la «cavité». Les molécules peuvent donc «reconnaître» un cation et l’extraire sélectivement d’un mélange.
Puisque les cryptands entourent de toutes parts le cation, celui-ci est d’autant plus retenu comme dans une cage. Les éthers-couronnes agissent plutôt tels des «clôtures» pour garder le cation métallique.
-
Applications dans l’industrie et la recherche :
L’utilisation des cryptands est importante. En effet, ils peuvent permettre la dissolution de certaines espèces moléculaires dans des solvants organiques comme du permanganate de potassium avec de l’alcool en capturant le cation, K+ , ce qui permet la séparation des atomes et la dissolution.
De même, ils sont utilisés dans la décontamination des souris dont l’organisme recèle du strontium radioactif sans en faire varier le taux de calcium, c’est à dire ne pas altérer la vie des animaux de laboratoire à la suite des expériences.
Les applications peuvent être multiples et comment savoir où nous irons en sachant créer des molécules aux caratéristiques impressionantes de sélectivité?
-
Citation :
« Mon attirance pour les phénomènes biologiques m’amena à me demander comment un chimiste pouvait contribuer à l’étude des manifestations biologiques tout en restant chimiste. »
-
Lien d’un site très intéressant sur Lehn et ses travaux :
http://membres.lycos.fr/xjarnot/Chimistes/Nobel_1985.html
-
Sitographie et bibliographie :
http://membres.lycos.fr/xjarnot/Chimistes/Nobel_1985.html
Cours de chimie organique de Paul Arnaud