Projet : Impact des activités humaines sur l’équilibre biophysique du milieu marin dans la baie de l’Aiguillon
3e du collège Pierre Mendès France & 2nd du Lycée Saint-Exupéry
Mardi 19 et jeudi 21 janvier 2016
A l’heure où les élèves se sont constitués en petits groupes de recherche, notre partenaire l’E.C.O.L.E. de la mer est venu nous présenter un protocole expérimental permettant d’évaluer l’impact de différents polluants sur le développement embryonnaire d’un animal commun de nos estrans : l’oursin violet (Paracentrotus lividus).
-
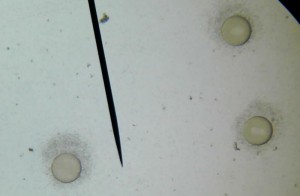
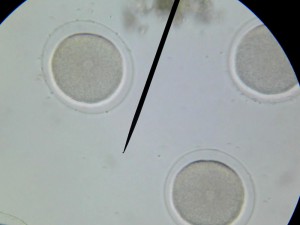
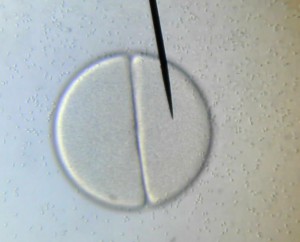
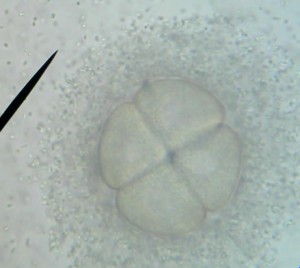
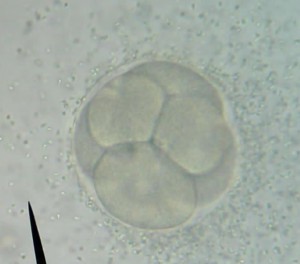
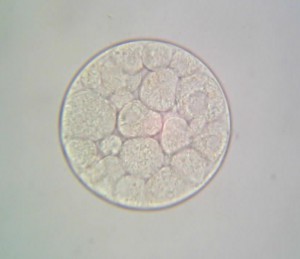
Le principe est simple : Une même quantité d’ovules fécondés est mise à incuber pendant 48 heures dans deux milieux de culture différents, un milieu non pollué et un milieu contenant un ou plusieurs polluants. A l’issu de cette période d’incubation, la quantité et la qualité des larves d’oursin trouvées dans les deux milieux sont comparées.
Ce sont les élèves de 3e qui ont eu en charge de récolter les gamètes, d’effectuer les fécondations in vitro et de mettre en place les premières étapes du protocole.
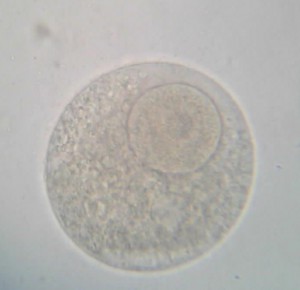
48 heures plus tard, l’ensemble du groupe (collégiens et lycéens) s’est retrouvé pour la lecture de l’expérience. En temps normal, 48 heures suffisent pour qu’une cellule-œuf se développe et atteigne le stade de plutéus (stade larvaire planctonique de l’oursin). Malheureusement, et malgré la mise en place de réplicats, aucune cellule-œuf ne s’est développée au-delà du stade morula. La discussion autour de ce résultat est en cours…
Un petit groupe d’élèves envisage maintenant d’adapter ce protocole pour tester l’impact du zinc sur le développement larvaire des oursins.
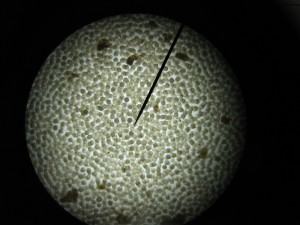
Voici quelques photographies prises à cette occasion :

L’injection d’une solution de KCl dans les gonades cause un choc osmotique permettant la libération des gamètes